Axit sunfuric (H2SO4) loãng là một trong những hóa chất phổ biến nhất trong phòng thí nghiệm và công nghiệp. Hiểu rõ Tính Chất Hóa Học Của H2so4 Loãng là điều cần thiết để ứng dụng nó một cách an toàn và hiệu quả. Bài viết này sẽ đi sâu vào phân tích tính chất hóa học của H2SO4 loãng, cung cấp kiến thức chi tiết và hữu ích cho bạn.
Tính Axit Mạnh của H2SO4 Loãng
H2SO4 loãng là một axit mạnh, có khả năng phân ly hoàn toàn trong nước tạo thành ion H+ và ion sunfat (SO42-). Tính axit mạnh này thể hiện qua các phản ứng đặc trưng như làm đổi màu quỳ tím sang đỏ, tác dụng với bazơ tạo thành muối và nước. Nồng độ H+ cao trong dung dịch H2SO4 loãng chính là nguyên nhân gây ra tính ăn mòn của nó. Việc hiểu nêu tính chất hóa học của h2so4 loãng là rất quan trọng trong việc lựa chọn vật liệu chứa đựng và biện pháp an toàn khi làm việc với hóa chất này.
H2SO4 Loãng Tác Dụng với Kim Loại
H2SO4 loãng phản ứng với nhiều kim loại đứng trước hydro trong dãy điện hóa, giải phóng khí hydro và tạo thành muối sunfat tương ứng. Ví dụ, phản ứng giữa H2SO4 loãng và sắt (Fe) tạo ra FeSO4 và khí H2. Phản ứng này là minh chứng rõ ràng cho tính chất oxi hóa của H+ trong dung dịch axit. Tìm hiểu thêm về tính chất và dãy điện hóa của kim loại sẽ giúp bạn dự đoán được khả năng phản ứng của kim loại với H2SO4 loãng.
H2SO4 loãng không phản ứng với các kim loại đứng sau hydro trong dãy điện hóa như đồng (Cu), bạc (Ag) và vàng (Au). Điều này là do ion H+ trong H2SO4 loãng không đủ mạnh để oxi hóa các kim loại này.
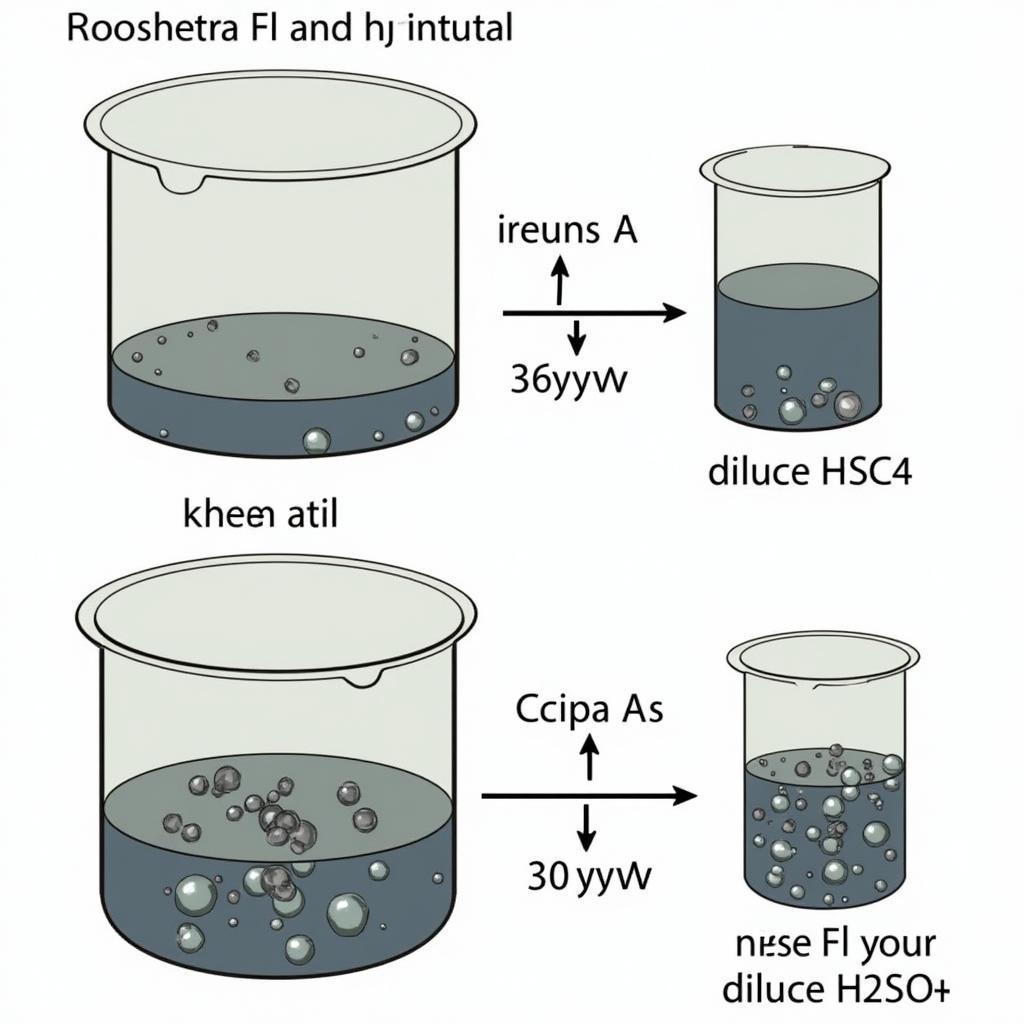 H2SO4 loãng tác dụng với kim loại
H2SO4 loãng tác dụng với kim loại
Tác Dụng với Oxit Bazơ và Bazơ
H2SO4 loãng phản ứng với oxit bazơ và bazơ tạo thành muối sunfat và nước. Phản ứng này là phản ứng trung hòa điển hình của axit và bazơ. Ví dụ, phản ứng giữa H2SO4 loãng với NaOH tạo ra Na2SO4 và H2O. Kiến thức về tính chất hóa học của kim loại cho ví dụ có thể giúp bạn hiểu rõ hơn về phản ứng giữa H2SO4 với các oxit kim loại.
Lưu Ý Khi Sử Dụng và Bảo Quản H2SO4 Loãng
H2SO4 loãng có tính ăn mòn, do đó cần phải cẩn thận khi sử dụng và bảo quản. Nên đeo găng tay, kính bảo hộ và mặc áo khoác phòng thí nghiệm khi làm việc với H2SO4. nhiệt độ bảo quản hóa chất trong phòng thí nghiệm là yếu tố quan trọng cần được lưu ý để đảm bảo an toàn và duy trì chất lượng của hóa chất. Bảo quản H2SO4 loãng ở nơi khô ráo, thoáng mát, tránh xa các chất dễ cháy và các kim loại hoạt động.
 Bảo quản H2SO4 loãng
Bảo quản H2SO4 loãng
Kết luận
Tóm lại, tính chất hóa học của H2SO4 loãng bao gồm tính axit mạnh, khả năng tác dụng với kim loại, oxit bazơ và bazơ. Hiểu rõ những tính chất này là vô cùng quan trọng để sử dụng H2SO4 loãng một cách an toàn và hiệu quả trong phòng thí nghiệm và công nghiệp.
Khi cần hỗ trợ hãy liên hệ Số Điện Thoại: 0373298888, Email: [email protected] Hoặc đến địa chỉ: 86 Cầu Giấy, Hà Nội. Chúng tôi có đội ngũ chăm sóc khách hàng 24/7.