Tính oxi hóa của các đơn chất halogen là một chủ đề quan trọng trong hóa học. Bài viết này sẽ So Sánh Tính Oxi Hóa Của Các đơn Chất Halogen, từ đó giúp bạn hiểu rõ hơn về xu hướng biến đổi tính chất trong nhóm halogen. Ngay từ đầu, chúng ta sẽ đi sâu vào việc phân tích và so sánh khả năng oxi hóa của các nguyên tố này.
Tính Oxi Hóa của Halogen Giảm Dần từ Flo đến Iot
Xu hướng tính oxi hóa của các đơn chất halogen giảm dần từ flo (F) đến iot (I). Điều này có nghĩa là flo là chất oxi hóa mạnh nhất trong nhóm halogen, trong khi iot là chất oxi hóa yếu nhất. đơn chất halogen nào có tính oxi hóa mạnh nhất. Xu hướng này có thể được giải thích dựa trên cấu trúc electron của các nguyên tử halogen.
 So sánh Tính Oxi Hóa của Halogen
So sánh Tính Oxi Hóa của Halogen
Ảnh Hưởng của Cấu Trúc Điện Tử lên Tính Oxi Hóa
Khi đi xuống nhóm halogen, bán kính nguyên tử tăng dần. Điều này làm cho lực hút giữa hạt nhân và electron lớp ngoài cùng yếu đi, khiến cho việc thu thêm electron trở nên khó khăn hơn. Do đó, khả năng oxi hóa giảm dần. tính chất hóa học của nhóm halogen.
Độ Âm Điện và Tính Oxi Hóa
Độ âm điện cũng là một yếu tố quan trọng ảnh hưởng đến tính oxi hóa. Flo có độ âm điện cao nhất trong bảng tuần hoàn, do đó nó có khả năng hút electron mạnh mẽ, thể hiện tính oxi hóa mạnh. Ngược lại, iot có độ âm điện thấp hơn, nên tính oxi hóa cũng yếu hơn.
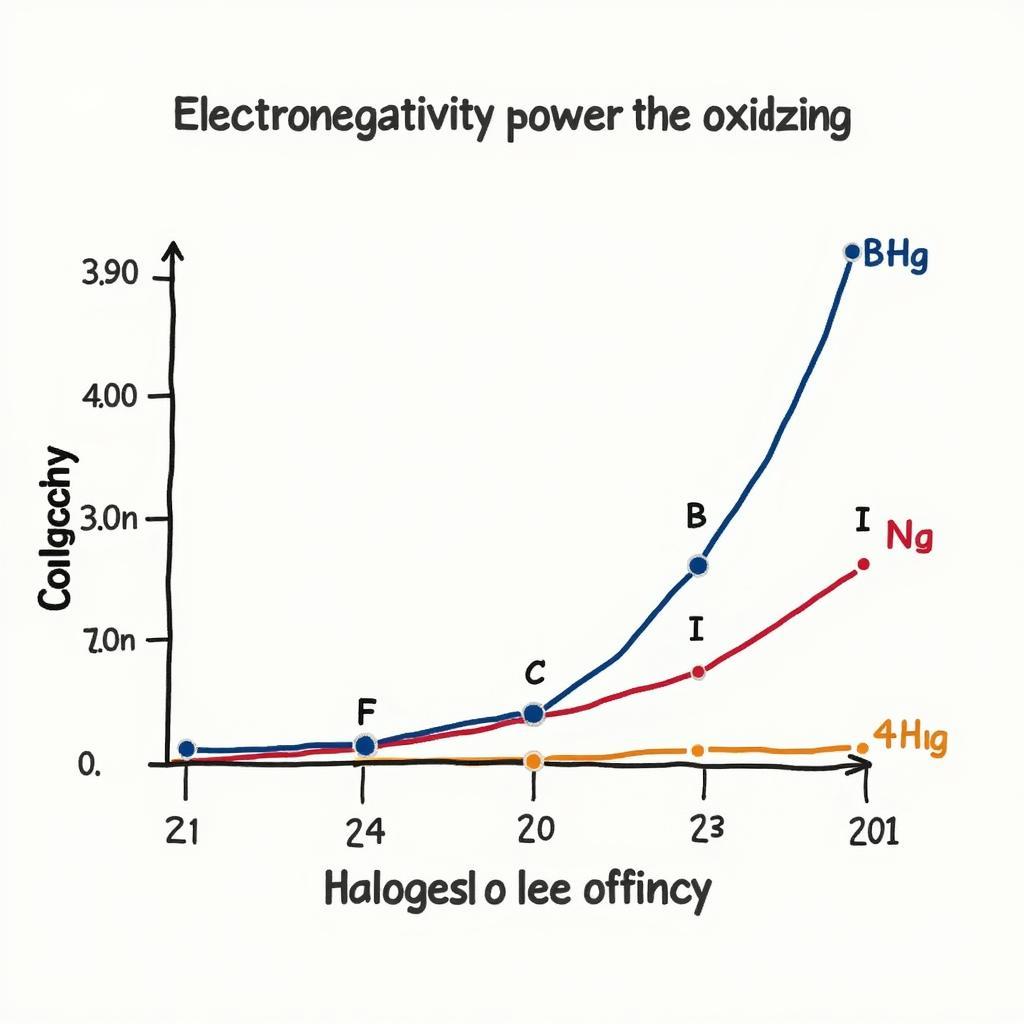 Độ Âm Điện và Tính Oxi Hóa của Halogen
Độ Âm Điện và Tính Oxi Hóa của Halogen
Minh Họa Tính Oxi Hóa của Halogen qua Phản Ứng
Tính oxi hóa của halogen có thể được minh họa qua các phản ứng hóa học. Ví dụ, flo có thể oxi hóa nước, trong khi clo chỉ có thể oxi hóa nước ở điều kiện ánh sáng. Brom và iot thì không thể oxi hóa nước. trong các hợp chất flo chỉ có số oxi hóa. Điều này chứng tỏ tính oxi hóa giảm dần từ flo đến iot. các halogen khá giống nhau về tính chất hóa học..
Ví dụ Phản Ứng với Kim Loại
Một ví dụ khác là phản ứng của halogen với kim loại. Flo phản ứng mãnh liệt với hầu hết các kim loại, trong khi iot phản ứng chậm hơn.
Kết luận
Tóm lại, so sánh tính oxi hóa của các đơn chất halogen cho thấy xu hướng giảm dần từ flo đến iot. Sự khác biệt này là do sự thay đổi về cấu trúc electron, bán kính nguyên tử và độ âm điện. Hiểu rõ về tính oxi hóa của halogen là rất quan trọng trong việc nghiên cứu và ứng dụng các chất này.
FAQ
- Halogen nào có tính oxi hóa mạnh nhất? Flo
- Tại sao tính oxi hóa của halogen giảm dần từ flo đến iot? Do bán kính nguyên tử tăng và độ âm điện giảm
- Làm thế nào để minh họa tính oxi hóa của halogen? Qua các phản ứng hóa học với nước và kim loại
- Độ âm điện ảnh hưởng đến tính oxi hóa như thế nào? Độ âm điện càng cao, tính oxi hóa càng mạnh
- Ứng dụng của tính oxi hóa halogen là gì? Trong sản xuất các hợp chất hóa học, khử trùng nước, v.v.
- Iot có thể oxi hóa nước không? Không
- Flo phản ứng với kim loại như thế nào? Mạnh liệt
Mô tả các tình huống thường gặp câu hỏi.
- Tình huống 1: Học sinh thắc mắc về lý do tại sao Flo có tính oxi hóa mạnh nhất trong nhóm Halogen.
- Tình huống 2: Cần so sánh khả năng phản ứng của Clo và Brom với kim loại.
- Tình huống 3: Muốn tìm hiểu ứng dụng của tính oxi hóa của Iot trong y học.
Gợi ý các câu hỏi khác, bài viết khác có trong web.
- Đơn chất halogen nào có tính oxi hóa mạnh nhất?
- Tính chất hóa học của nhóm halogen là gì?
- Trong các hợp chất, Flo chỉ có số oxi hóa nào?