Phenol, một hợp chất hữu cơ thơm với công thức phân tử C6H5OH, thể hiện tính chất hóa học đặc trưng nhờ nhóm hydroxyl (-OH) gắn trực tiếp vào vòng benzen. Viết Pthh Thể Hiện Tính Chất Hóa Học Của Phenol là cách tuyệt vời để hiểu rõ hơn về hợp chất này. Bài viết này sẽ đi sâu vào các phản ứng hóa học của phenol, minh họa bằng phương trình phản ứng và giải thích chi tiết.
Tính Axit của Phenol
Phenol thể hiện tính axit yếu hơn axit cacboxylic nhưng mạnh hơn ancol. Điều này được thể hiện qua phản ứng của phenol với bazơ mạnh như NaOH:
C6H5OH + NaOH → C6H5ONa + H2O
Phản ứng này tạo ra muối phenolat (natri phenolat) và nước. Tính axit của phenol được giải thích bởi sự ảnh hưởng của vòng benzen lên nhóm hydroxyl, làm cho nguyên tử hydro trong nhóm -OH dễ dàng bị phân ly hơn so với ancol.
Phản ứng thế Hạt Nhân Điện Tử vào Vòng Benzen
Vòng benzen trong phenol rất dễ tham gia phản ứng thế hạt nhân điện tử. Nhóm -OH là nhóm đẩy electron, làm tăng mật độ electron ở vị trí ortho và para trên vòng benzen, do đó phản ứng thế thường xảy ra ở các vị trí này.
Phản ứng với Brom
Phenol phản ứng dễ dàng với dung dịch brom, ngay cả ở điều kiện thường, tạo kết tủa trắng 2,4,6-tribromphenol:
C6H5OH + 3Br2 → C6H2Br3OH + 3HBr
Phản ứng này được sử dụng để nhận biết phenol.
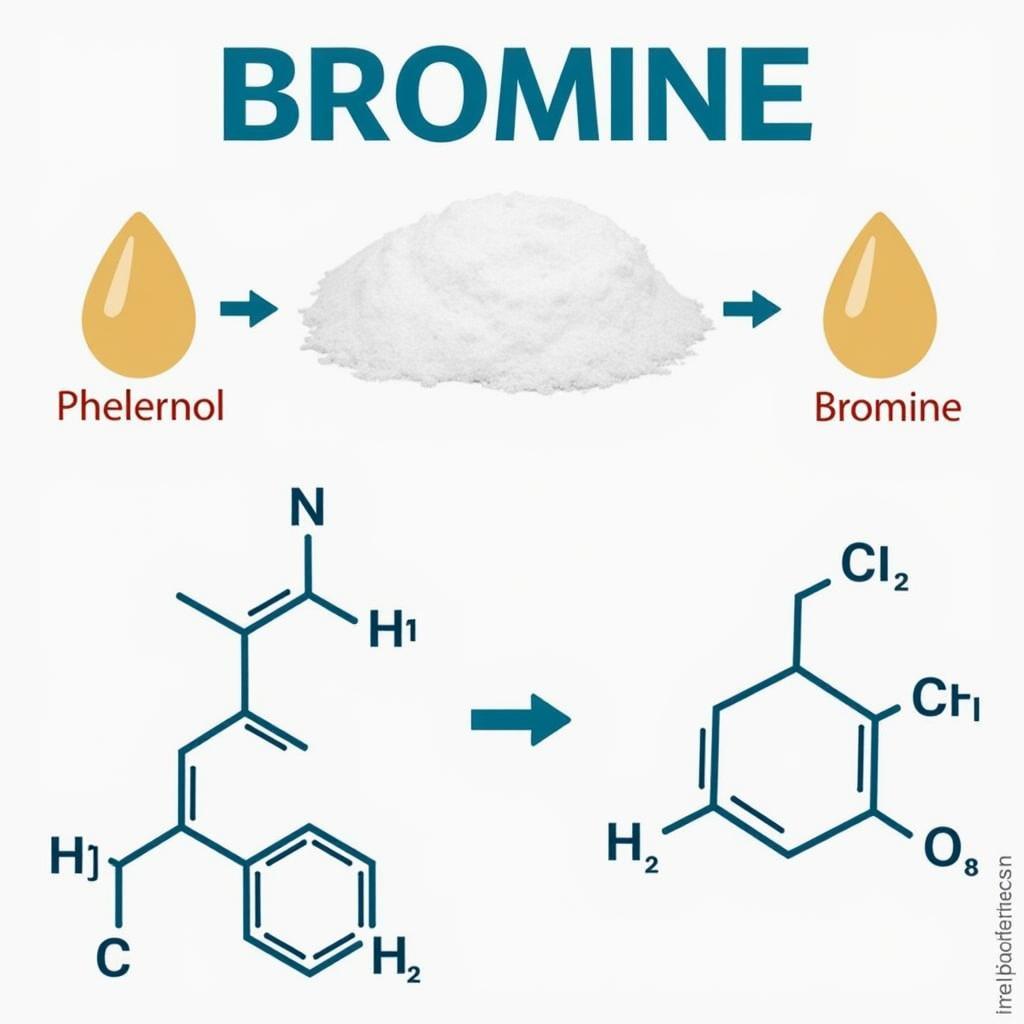 Phản ứng của Phenol với Brom
Phản ứng của Phenol với Brom
Phản ứng với Axit Nitric
Phenol phản ứng với axit nitric loãng tạo ra hỗn hợp ortho-nitrophenol và para-nitrophenol:
C6H5OH + HNO3 → C6H4(NO2)OH + H2O
Phản ứng này minh họa sự định hướng của nhóm -OH trong phản ứng thế.
 Phản ứng của Phenol với HNO3
Phản ứng của Phenol với HNO3
Phản ứng Este Hóa
Tương tự như ancol, phenol cũng có thể tham gia phản ứng este hóa với anhydrit axit hoặc clorua axit:
C6H5OH + CH3COCl → C6H5OCOCH3 + HCl
Kết luận
Viết PTHH thể hiện tính chất hóa học của phenol là bước quan trọng để hiểu rõ tính chất và ứng dụng của hợp chất này. Từ tính axit, phản ứng thế hạt nhân điện tử, đến phản ứng este hóa, phenol thể hiện sự đa dạng trong phản ứng hóa học. Hiểu rõ các PTHH này giúp chúng ta vận dụng phenol hiệu quả trong nhiều lĩnh vực khác nhau.
FAQ
-
Phenol có phải là ancol không?
Không, phenol không phải là ancol mặc dù có nhóm -OH. Nhóm -OH trong phenol gắn trực tiếp vào vòng benzen, tạo nên sự khác biệt về tính chất so với ancol. -
Tại sao phenol có tính axit?
Tính axit của phenol là do ảnh hưởng của vòng benzen, làm cho liên kết O-H phân cực mạnh hơn, dễ dàng giải phóng H+. -
Phenol có độc không?
Phenol có thể gây độc nếu tiếp xúc trực tiếp với da hoặc hít phải. Cần thận trọng khi sử dụng phenol. -
Ứng dụng của phenol là gì?
Phenol được sử dụng trong sản xuất nhựa, chất khử trùng, thuốc nhuộm và nhiều sản phẩm khác. -
Làm thế nào để nhận biết phenol?
Phản ứng với dung dịch brom tạo kết tủa trắng 2,4,6-tribromphenol là một cách để nhận biết phenol.
Gợi ý các câu hỏi khác, bài viết khác có trong web.
- Tìm hiểu về cấu trúc phân tử của phenol.
- Các ứng dụng của phenol trong công nghiệp.
- So sánh tính chất của phenol và ancol.